기술 연구개발 view more
VIEW MORE
1. 당뇨병 치료용 human pluripotent stem cells (PSC: iPS and ES) 기반 췌도세포 개발
기술 배경 및 개요
- 당뇨병은 전 세계 인구 약 9%정도가 앓고 있는 만성질환으로, 이 중 약 10%에 해당하는 제1형 당뇨병 환자들은 인슐린 주사가 절대적으로 필요함.
- 인슐린 주사에도 불구하고 만성적으로 발생하는 합병증을 예방하지 못해 환자의 수명은 정상인에 비해 평균 10년 정도 짧음. (Nathan AM et al. Eng. J. Med. 328:1676-1684, 1993)
- 북미와 유럽에서 뇌사자의 췌도를 이식한 예가 6천 건 정도 보고되었고, 이 중 가장 우수한 성적은 환자가 20년째 인슐린 주사를 맞지 않고도 정상혈당을 유지하고 있어 이것이 근본적 치료에 가까움. (Braulio AM et al. The Lancet Diabetes and Endocrinol. 10:519-532, 2022)
- 췌도의 공급원이 부족하기 때문에 돼지 췌도와 줄기세포를 이용하려는 노력이 활발히 진행되어 왔음.
- 본 기술은 배아줄기세포 (Embryonic stem cell) 및 유도만능줄기세포 (Induced pluripotent stem cell)과 같은 인간 전분화능줄기세포를 췌도세포로 분화하여 이식하는 기술로써, 이론적으로 완치를 이룰 수 있는 기술임.
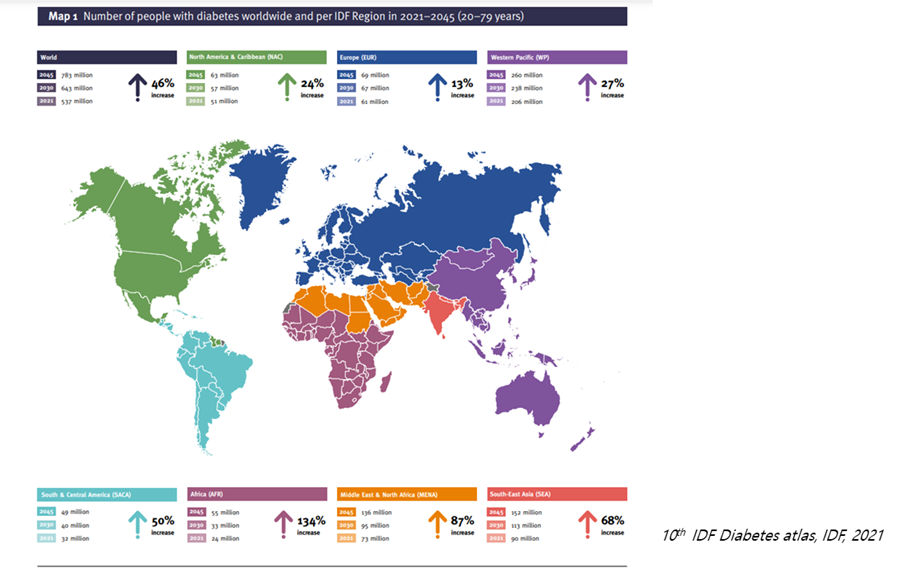
그림1. 전 세계 당뇨병 유병율과 환자수
2021년 기준 전 세계 당뇨병 환자수는 5억 3천 7백만 명이고, 아프리카(134%), 중동(87%), 동남아시아(68%), 남아메리카(50%)에서의 빠른 증가율 때문에 2045년 7억 8천 3백만 명으로 크게 증가할 것으로 예상됨. 이 중 본 기술 적용대상 환자수는 약 5~10%에 해당할 것으로 예측됨.
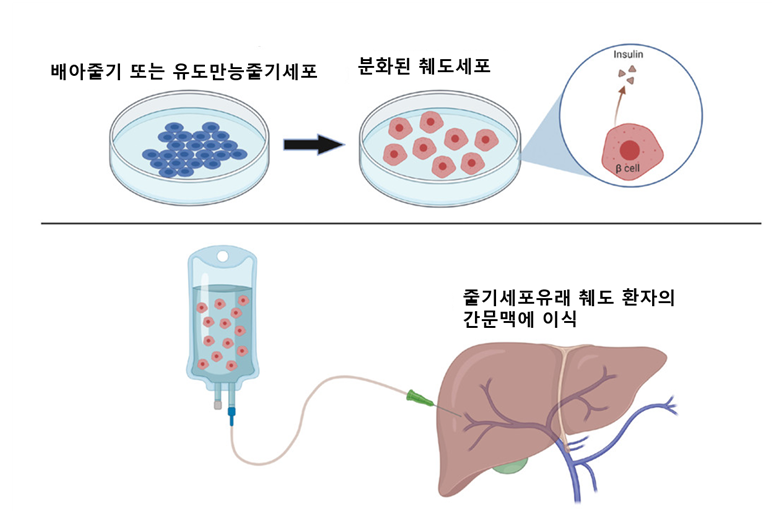
그림2. 줄기세포 유래 췌도 이식 모식도
인간의 배아줄기세포 또는 유도만능줄기세포를 체외에서 분화하여 인슐린을 생산하는 췌도를 만든 후 1형 당뇨병 환자의 간문맥을 통해 췌도를 이식함. 시술은 개복을 하지 않고 초음파를 보면서 긴 카테터를 이용하여 주사하기 때문에 하루 이틀 후 퇴원이 가능함.
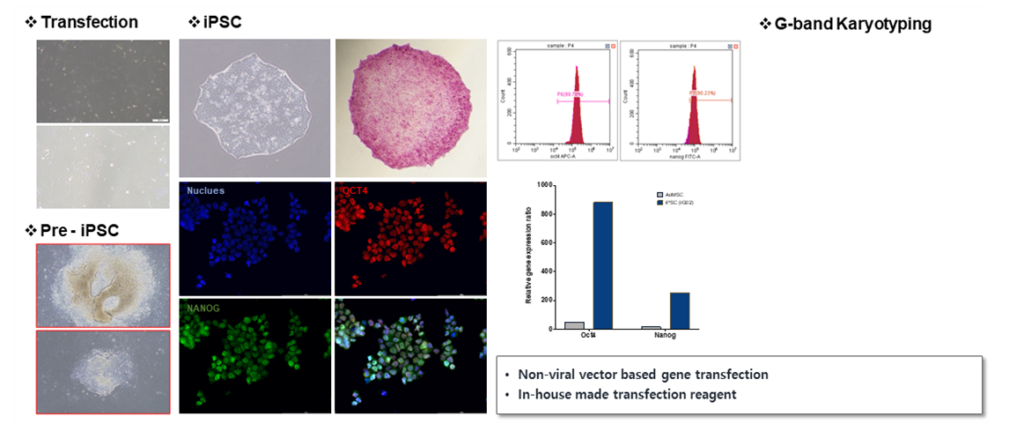
그림3. 인간 유도만능줄기세포 확립
정상인의 혈액세포에 Yamanaka factors (Oct4, Klf4, Sox2, cMyc)를 도입시켜 역분화를 유도함. 역분화된 유도만능줄기세포는 전분화능 표지인 Oct4와 Nanog를 발현하며 정상적인 핵형을 가지고 있어서 안전성이 보장됨.
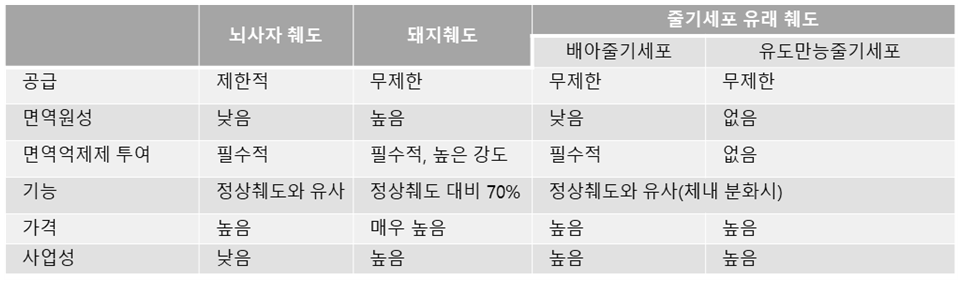
표2. 줄기세포 유래 췌도와 기타 치료제의 장단점 비교
연구개발 내용
- 현재 본사에서는 성인 혈액세포 및 섬유아세포에 plasmid vector 도입으로 유도만능줄기세포를 확립하는 기술을 확보하고 있고, 이미 다양한 종류의 인간 배아줄기세포 및 유도만능줄기세포를 보유하고 있음.(그림3, 표1)
- 유도만능줄기세포의 경우 자가유래의 세포이기 때문에 면역억제제 없이 투여가 가능함.
- 뇌사자 기증에 의존하지 않고 췌도를 생산할 수 있기 때문에 환자의 편의에 따라 시술을 자유롭게 조정할 수 있음.
- 돼지췌도에 비해 면역원성이 낮고 생산된 인슐린 분자의 구조도 정상췌도의 인슐린과 같음.
- 인간 전분화능 줄기세포를 발생단계를 체외에서 모사하여 definitive endoderm>primitive gut tube>posterior foregut>pancreatic endoderm>pancreatic endocrine precursor>immature beta cells>mature beta cells 순서로 분화시킴.
- 본 연구진은 분화공정을 개발하여 줄기세포유래 췌도를 생산할 수 있으며, 이를 당뇨병이 유도된 NOD/SCID 면역 결핍 마우스에 이식하여 혈당조절 능력을 확인함. 특히, 내배엽 (endodermal stem cell)및 췌도세포의 전구세포가 되는 1+PDX-1+ pancreatic progenitor 세포를 순수하게 분리할 수 있는 기술이 있음.
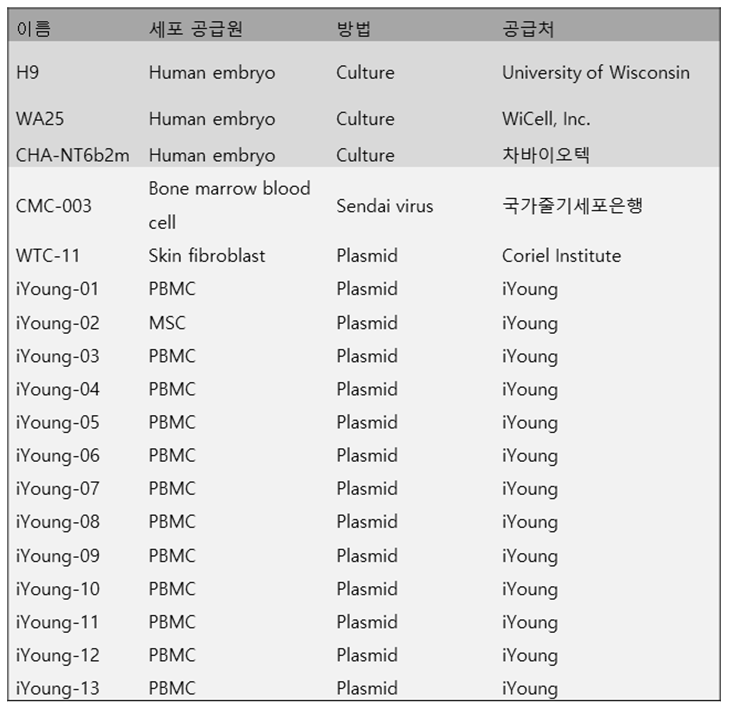
표1. 본사가 보유한 인간배아줄기세포 및 유도만능줄기세포
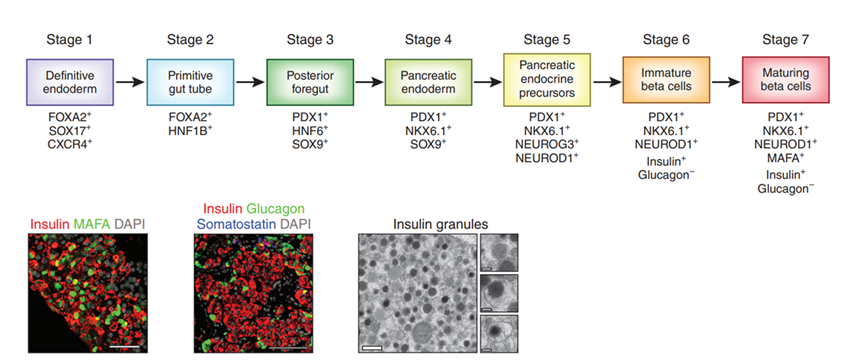
그림4. 인간 전분화능 줄기세포 유래 췌도 분화 공정 (Nature Biotechnology 32:1100)
인간의 배아줄기세포 또는 유도만능줄기세포를 인간의 발달과정을 모사하여 체외에서 7단계로 분화하여 인슐린을 생산하는 췌도세포를 만듦. 만들어진 인슐린 분비세포는 정상적인 인슐린 과립을 가지고 있고 베타세포의 성숙지표인 MafA를 발현함.
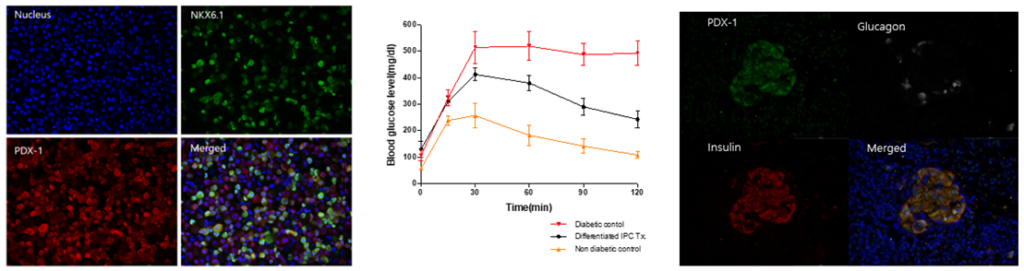
그림5. 췌도 전구세포 획득, 당뇨병쥐에 췌도 이식 후 내당능 검사 및 이식편에서 췌도 관찰
인간 유도만능줄기세포로부터 유래된 NKX6.1+PDX-1+ 췌도 전구세포, 분화된 췌도를 당뇨병이 유도된 NOD/SCID 마우스의 신장막 아래 이식한 후 30일째 수행한 내당능 검사 및 이식 90일 후 이식된 부위에서 관찰된 줄기세포 유래 췌도
2. 대사 기능장애 관련 지방간질환 치료용 신약 개발
기술 배경 및 개요
- 비만, 당뇨병 인구의 증가에 따라 대사 기능장애 관련 지방간질환 (Metabolic Dysfunction-Associated Steatotic Liver Disease, MASLD)의 유병률이 가파르게 증가하고 있으며, 2049년에는 7%에 달할 것으로 예측됨. (Clin Mol Hepatol. 2022) (그림 1)
- 특히, 지방증과 함께 간세포 손상 및 염증을 동반하는 MASLD의 심각한 형태인 대사이상 관련 지방간염 (Metabolic dysfunction-associated steatohepatitis, MASH)은 치료되지 않을 경우, 섬유화의 진행으로 인해 간경변증, 간부전, 나아가 간암으로 이어져 간이식 및 사망을 초래하는 심각한 질병임. (그림 2)
- MASH 환자를 대상으로 비타민 E와 pioglitazone 등이 Off-label로 처방되고 있으나, 증상 억제에 부분적인 효과만을 보이며, 안전성 문제 등으로 인해 사용이 제한적임.
- 현저히 높은 MASH 이환율 및 사망률 위험에도 불구하고, 현재까지 MASH 질환에 대하여 공식적으로 허가된 약물은 부재한 상황이며, 이에 따라 미충족 의료수요 (Unmet medical needs)가 매우 높은 질환임.
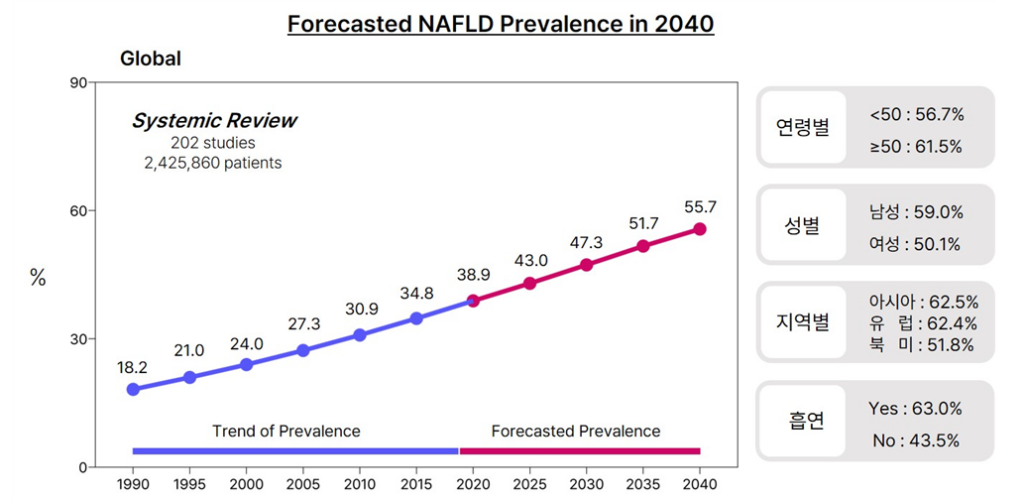
그림1. 대사 기능장애 관련 지방간질환 (MASLD, 전 NAFLD)의 유병률 전망
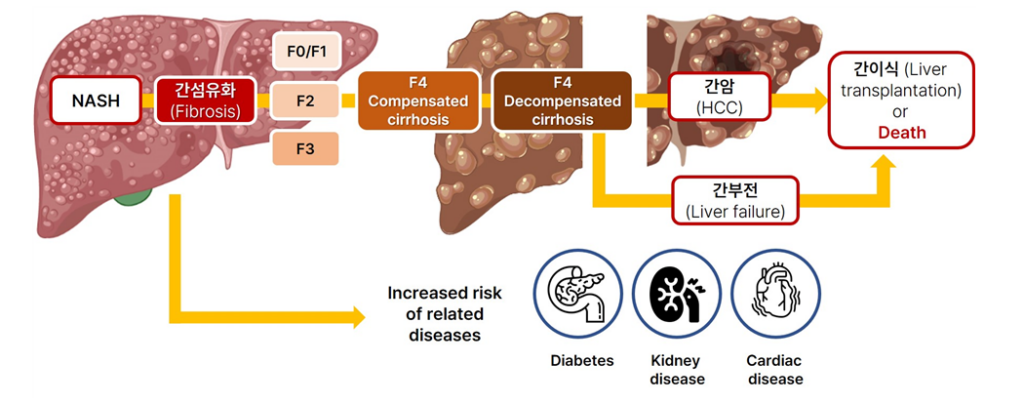
그림2. 대사이상 관련 지방간염 (MASH, 전 NASH) 진행 및 위험요소
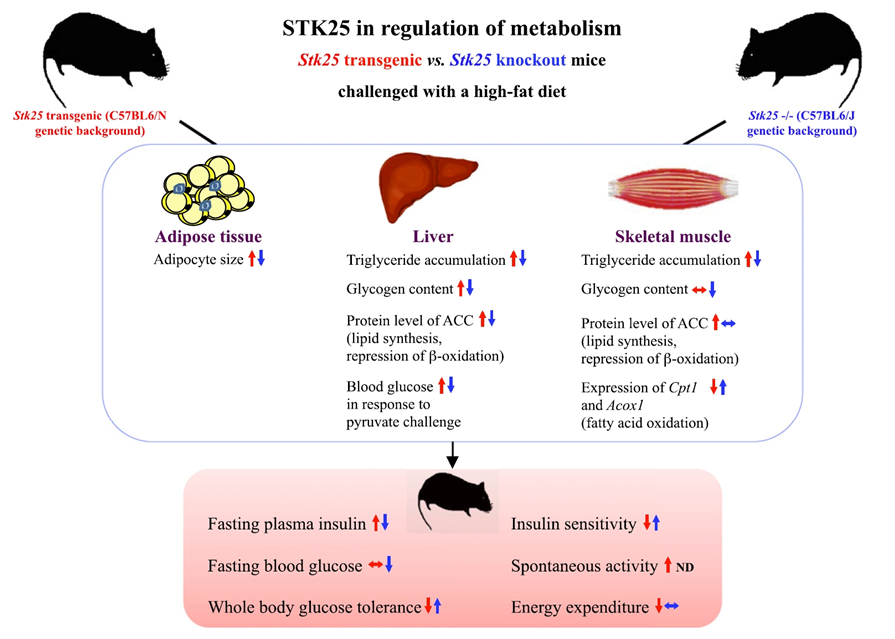
그림3. STK25 발현에 따른 장기별 대사조절 변화 (Diabetes, 2015)
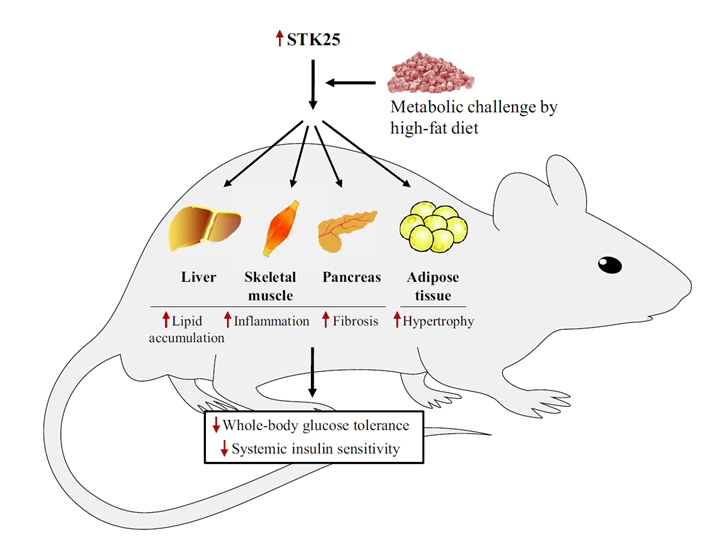
그림4. STK25 활성화에 따른 인슐린 및 포도당 항상성의 불균형 초래
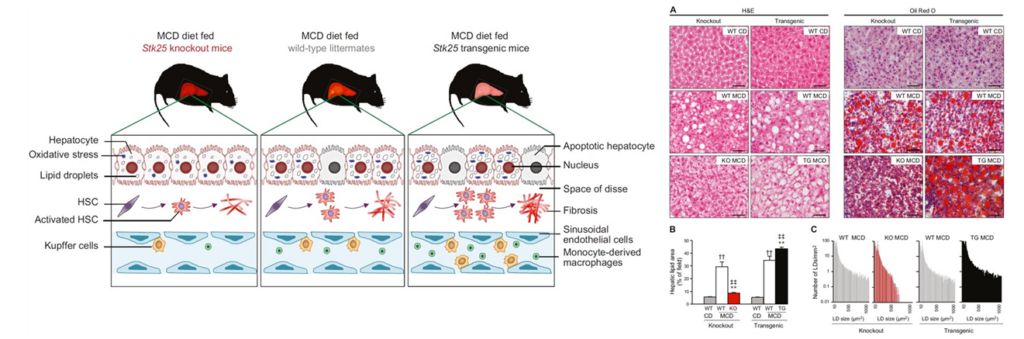
그림6. STK25 Knockout 마우스에서 NASH 병태생리 억제 양상
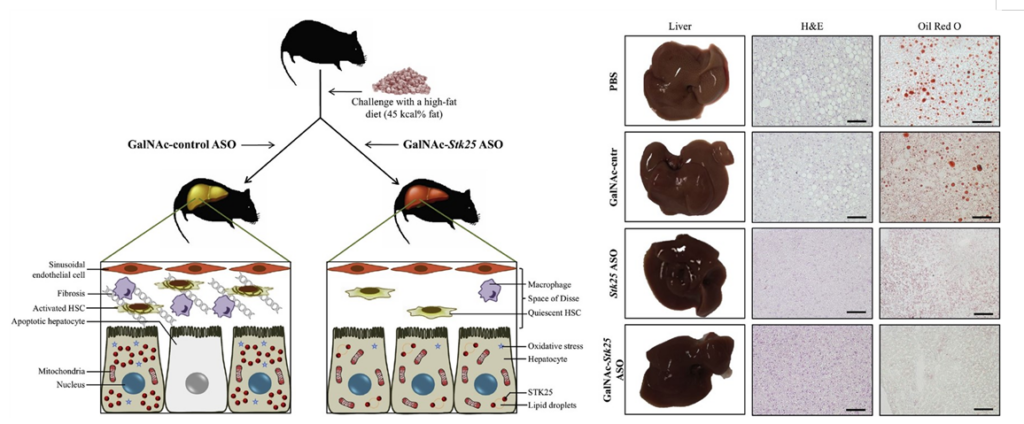
그림7. STK25 antisense oligonucleotides 투여에 의한 간세포 보호효과
연구개발 내용
- 고지방식이를 투여한 STK25 과발현 마우스에서 지방 조직의 증가, 조직 내 중성지방, 글리코겐의 축적 및 지방합성의 증가, 혈액 내 glucose의 증가로 인한 insulin 저항성 등이 관찰되었음. 한편, STK25를 유전적으로 결핍시킨 마우스의 경우 이러한 지질의 만성적 노출에 의한 대사산물로부터 보호 효과가 관찰됨으로써 대사조절에서 STK25의 중요성이 인지되었음. (Diabetes, 2015) (그림 3)
- STK의 과도한 활성이 인슐린 저항성 촉진 및 포도당의 항상성 불균형을 초래할 뿐만 아니라, 간세포에 지방축적을 유도한다는 것이 최근 연구들에서 알려짐에 따라, STK25는 MASH의 잠재적 신규 표적으로 인식되고 있음. (J Endocrinol, 2017) (그림 4)
- 실제 STK25 mRNA 및 단백질의 유의한 증가가 NASH 환자의 간 생검에서 확인되었으며, 발현량의 증가가 간 지방증 및 소엽 염증(lobular inflammation)의 중증도와도 관련됨이 밝혀짐. (FASEB J, 2016; Hepatol Commun, 2018) (그림 5)
- 다양한 NASH 질환 동물모델 (MCD-diet, High-fat diet)에서 STK25의 유전적 결핍 (STK25 knockout mice) 또는 antisense oligonucleotide 투여에 의한 선택적 STK25 억제가 NASH의 다양한 병태생리적 양상 (지방증, 염증성 침윤 및 섬유증 등)을 뚜렷하게 완화 시키는 것으로 보고됨. (FASEB J, 2016, Cell Mol Gastroenterol Hepatol, 2019) (그림6,7)
- 또한, 최근 연구결과들에서 STK25 신호전달 경로의 차단은 비알코올성 지방간 질환에 의해 유발되는 간암 (NASH-induced hepatocellular carcinoma) 및 당뇨성 신장 질환 (diabetic kidney disease)을 유의하게 억제시키는 것으로 보고됨으로써, STK25가 NASH 뿐만 아니라 NASH 동반 질환 및 다양한 대사 관련 질환의 치료 표적으로도 인지되고 있음. (JCI Insight, 2020; Cell Mol Gastroenterol Hepatol, 2021) (그림8)
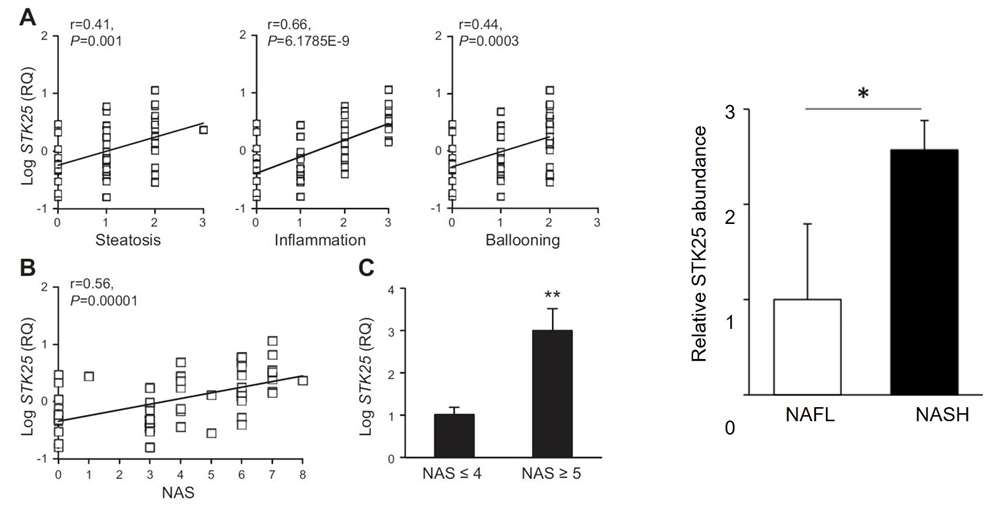
그림5. MASH (전 NASH) 환자의 간 조직에서 STK25의 발현 증가
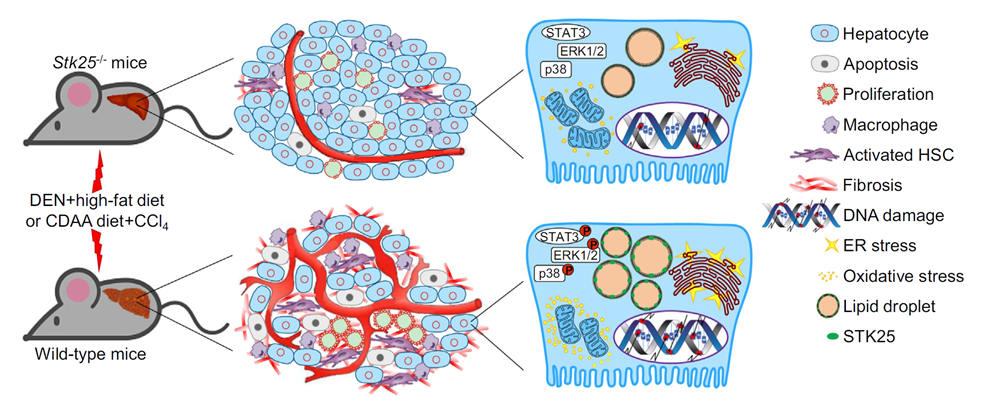
그림8. STK25 신호전달 길항에 의한 간세포암 억제 효과

